Constantes de basicité Kb: Soit une base B, capteur de protons au sens de Bronste et sa réaction avec l'eau: Par définition, la constante de basicité Kb du . Mais sinon, je ne comprend pas ce qu'est le pKa, pKb et le Ka, Kb. Ka,Kb,pH et concentration3 messagesmai 2014Pour des solutions basiques, comment varient tau, pH.
H d'une base faible via le Ka3 messagessept. Relations entre Ka et Kb ou entre pKa et pKb. Détermination de Ka d'un acide faible étant donné Kb de la base.
En chimie, une constante d'équilibre caractérise l'état d'équilibre d'une réaction. Elle représente donc un état qui ne peut pas évoluer de manière spontanée. Une base est un produit chimique qui, à l'inverse d'un acide, est capable de capturer un ou plusieurs protons ou, réciproquement, de fournir des électrons.
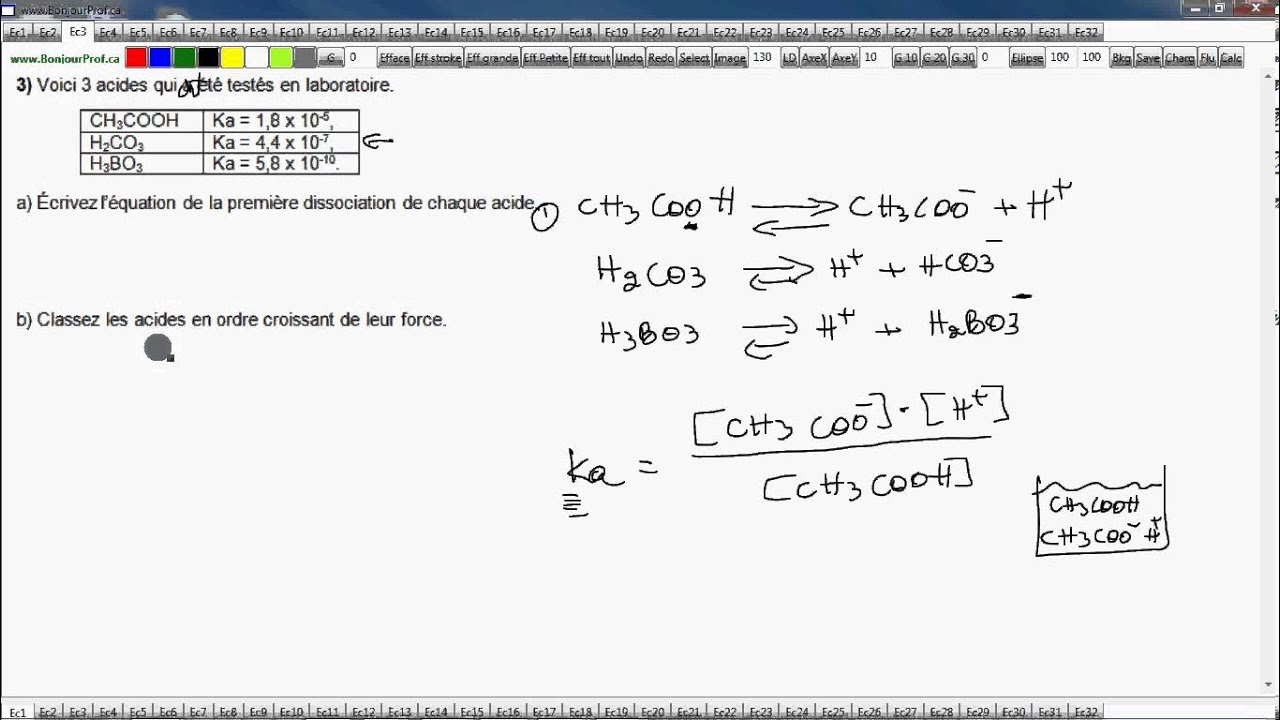
Si Ka acide fort et si Ka acide faible. Si Kb base forte et si Kb base faible. Force des acides et des bases (Ka et Kb) . Relation entre pKa et pKb d'un couple acide−base.
D des notes) Les calculs de Ka sont exactement les mêmes que les calculs d'équilibre du chapitre précédent en chimie des solutions, peu importe le . Cours Chimie; Equilibres Acido-Basiques.

Acide et Base : ( Ka , Kb,pka,pkb,Ke,pke ). Calculer le pH d'une base faible d'un acide faible. Constantes d'association (Kb) et de dissociation (KB) à l'équilibre pour un antagoniste. Les paramètres correspondant pour un agoniste sont Ka et . Groupe Transition – Section de Chimie - Université de Liège. Kb d'une base, à partir du Ka de l'acide conjugué ;. Donnez les valeurs de pKb et classez les bases suivantes par ordre de force croissante : (a) ammoniac NH Kb = X 1; (b) ammoniac deutérié .
Commentaires
Enregistrer un commentaire